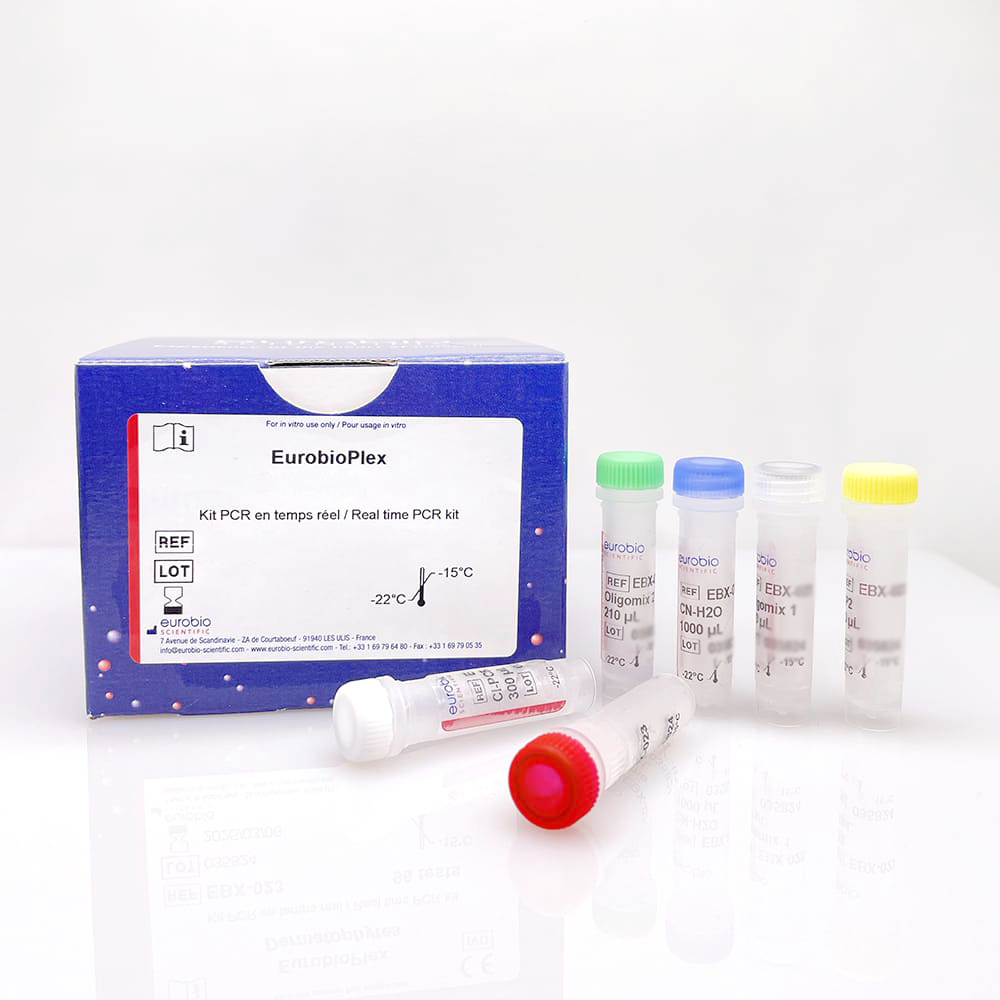
Eurobio Scientific devient l'une des premières entreprises européennes à obtenir le marquage CE IVDR pour les tests PCR
Eurobio Scientific (FR0013240934, ALERS, PEA-PME éligible), groupe français leader du diagnostic médical in vitro de spécialité et des sciences de la vie, annonce aujourd'hui avoir obtenu en avril 2023 les premiers marquages CE IVDR pour les tests PCR de sa gamme EurobioPlex, devenant ainsi l'une des premières sociétés européennes à obtenir un tel marquage pour ses propres produits.
Marquage CE IVDR des tests PCR Dans le cadre de la nouvelle réglementation IVDR, Eurobio Scientific a reçu les marquages CE IVDR qui permettent la commercialisation des 3 premiers tests PCR de sa gamme EurobioPlex en tant que dispositifs médicaux de diagnostic in vitro de classe C, nécessitant une expertise en diagnostic moléculaire des maladies infectieuses. Les autres tests de la gamme EurobioPlex, qui étaient déjà marqués CE selon l'ancienne réglementation (Directive 98/79/CE) avant le 26 mai 2022, bénéficient d'une période d'extension qui leur permet d'être commercialisés jusqu'à l'obtention de leur marquage CE IVDR qui doit intervenir au plus tard en mai 2025 pour les dispositifs de classe D (maladies à haut risque, VIH, hépatites, etc.), mai 2026 pour la classe C, et mai 2027 pour les classes B et A stériles.
Obtention de la certification ISO IVDR
Ce marquage CE fait suite à l’audit annuel de la société par son organisme notifié français, GMED, au cours duquel sa certification ISO 13485:2016 a été renouvelée pour 3 ans (certificat N°39268 rev. 0) avec un système de management de la qualité conforme aux exigences du règlement (UE) 2017/746 – IVDR qui impose de nouvelles règles plus restrictives pour le maintien de la certification et du marquage CE des produits. Ce système couvre tous les aspects opérationnels d’Eurobio Scientific, en France, liés aux processus et procédures qui assurent la qualité et la performance des tests PCR produits par la société, prérequis obligatoire pour se conformer aux nouvelles exigences IVDR. Cette certification ISO a été obtenue pour les « dispositifs de diagnostic in vitro : kits, réactifs et matériels de contrôle destinés à être utilisés pour détecter la présence d’un agent infectieux ou l’exposition à un tel agent,
y compris les agents sexuellement transmissibles ». Elle permet donc à Eurobio Scientific de procéder de manière séquentielle au nouveau marquage CE de ses tests PCR actuels pour les maladies infectieuses et de marquer CE ses futurs tests dans le cadre de l'IVDR qui s'applique désormais à tous les nouveaux dispositifs médicaux de diagnostic in-vitro.